根据《药物临床试验质量管理规范》(2020年第57号)要求,为做好我院临床试验安全性事件报告及管理工作,保障受试者安全和权益,遵照GCP相关要求,现结合本院实际情况制定SAE/SUSAR报告工作要求如下。
一、定义
1. 严重不良事件(Serious Adverse Event,SAE),指受试者接受试验用药品后出现死亡、危及生命、永久或者严重的残疾或者功能丧失、受试者需要住院治疗或者延长住院时间,以及先天性异常或者出生缺陷等不良医学事件。
2. 可疑且非预期严重不良反应(Suspicious and Unexpected Serious Adverse Reactions,SUSAR),指临床表现的性质和严重程度超出了试验药物研究者手册、已上市药品的说明书或者产品特性摘要等已有资料信息的可疑并且非预期的严重不良反应。
3. 研发期间安全性更新报告(Development Safety Update Report,以下统称:DSUR)的主要目的是对报告周期内收集到的与在研药物(无论上市与否)相关的安全性信息进行全面深入的年度回顾和评估。
二、伦理委员会受理临床试验安全性事件报告范围
2020版GCP中,对于安全性报告,由旧版GCP的研究者发现严重不良事件(Serious Adverse Event, 以下统称:SAE)后及时报告申办者、临床试验机构、伦理委员会、药品监督管理部门和卫生健康主管部门,调整为研究者向申办者报告SAE,由申办者进行评估,再将评估后的可疑且非预期严重不良反应(Suspected Unexpected Serious Adverse Reaction,以下统称:SUSAR)报告,快速报告给所有参加临床试验的研究者及其所在临床试验机构、伦理委员会,并上报给国家药品监督管理部门和卫生健康主管部门。研究者收到申办者提供的临床试验的相关安全性信息后应当及时签收阅读,并应当向伦理委员会报告由申办者提供的SUSAR报告。
在此背景下,本中心伦理委员会现仅受理研究者递交的由申办方进行评估后的可疑且非预期严重不良反应SUSAR,与研发期间安全性更新报告DSUR。
三、SUSAR的递交流程与时限要求
在本中心开展的药物临床试验,研究者获知SAE后,立即向申办者书面报告,通常为24小时内,除非在研究方案中另有约定。申办者按内部标准操作流程进行综合分析评估,将评估为可疑且非预期严重不良反应(SUSAR)报告,不论是否为本中心发生,只要涉及的项目同时在本中心开展,均应快速报告给本中心研究者。研究者及时审阅签署SUSAR报告,并向本院临床试验机构和伦理委员会递交SUSAR报告。
SAE/SUSAR报告流程如下图(含首次、随访、总结报告)。
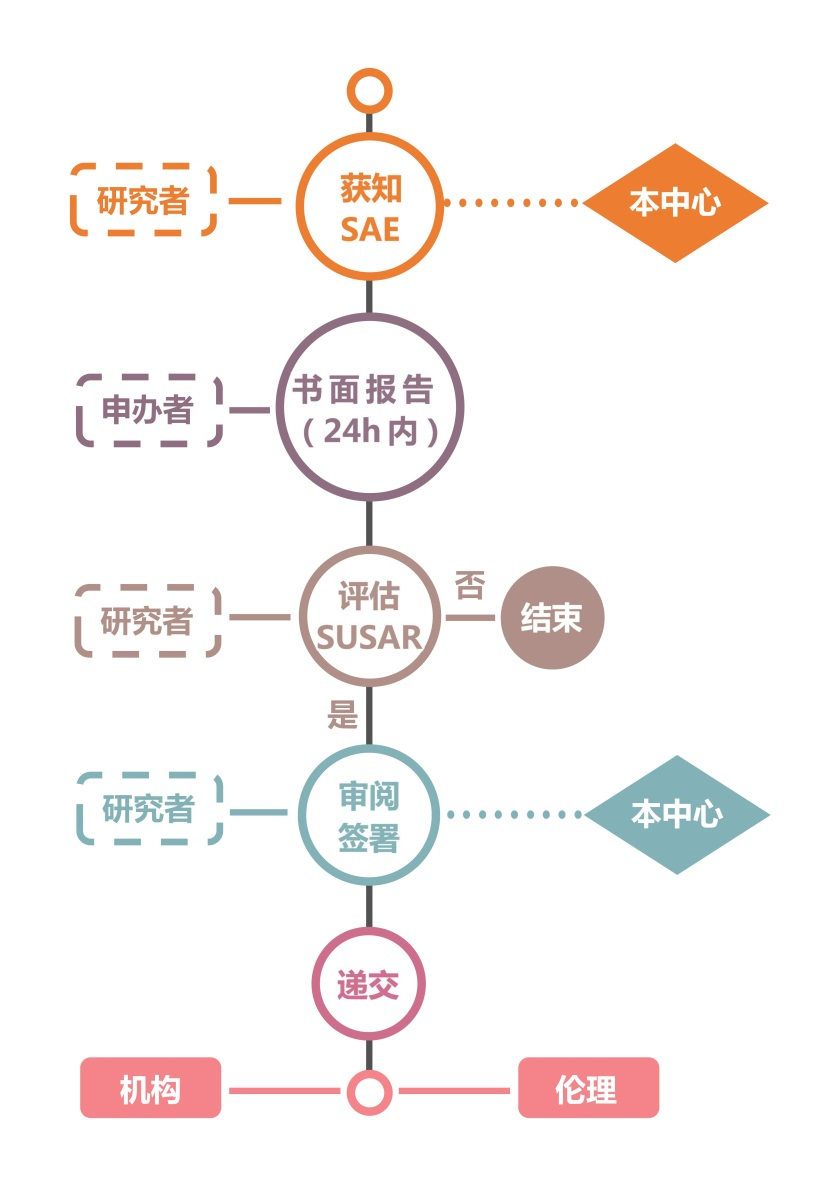
1. 递交流程:
申办者经评估后递交研究者,研究者初步审核签字后,递交伦理委员会和临床试验机构办公室。报告实际递交流程中,取得对方的签收回执,包括申办者取得研究者的签收回执、研究者取得伦理委员会的签收回执,以确认按时递交并递交成功。
2. 时限要求:申办者应按法规要求的时限(应当遵循7天和15天的快速报告要求)将SUSAR报告递交研究者审阅,由研究者上报本院伦理委员会和临床试验机构办公室, 具体要求如下:
①本中心SUSAR:本中心致死或危及生命的SUSAR应在申办者首次获知7天内,研究者报告伦理委员会,并在随后的8天内报告、完善随访信息;对于非致死或危及生命的SUSAR,应在申办者首次获知后15天内研究者尽快上报伦理委员会和临床试验机构办公室。(注:申办者首次获知当天为第0天)报告表格见 附件1:《本院可疑的非预期严重不良事件记录表》;
②非本中心SUSAR:研究者上报频次为1个月;报告表格见:附件2《可疑的非预期严重不良反应信息汇总表》;
③任何显著影响研究进行或增加受试者风险的SUSAR:申办者获知7天内研究者上报伦理委员会和临床试验机构办公室。
四、 报告材料要求
报告的纸质版与电子版材料需同步上报伦理办公室。
1.纸质版材料递交要求:
①本中心SUSAR所需表格见
附件3:《伦理审查申请及受理表(临床试验版)(V2.0)》
附件1:《本院可疑的非预期严重不良事件记录表》
②非本中心SUSAR所需表格见
附件3:《伦理审查申请及受理表(临床试验版)(V2.0)》
附件2:《可疑的非预期严重不良反应信息汇总表》
注:死亡事件SUSAR中的死亡事件报告,除符合SUSAR的一般要求外,研究者还应当向申办者和伦理委员会提供其他所需要资料,如尸检报告和最终医学报告。
2.电子版材料要求:
电子版请在纸质版材料通过形式审查后发送至伦理邮箱(aydefyllwyhbgs@163.com),邮件标题按照“文件编号+伦理受理号+项目简称+SUSAR发生时间”的格式进行编辑,邮件附件须使用压缩包文件递交(压缩包命名须邮件名称一致),不同文件不得合并扫描,文件需单独命名,须包含一份Word版及一份PDF版文件。
3.如有疑问请致电办公室。
联系人:钱老师,联系电话:0551-63806061。
附件
1.《本院可疑的非预期严重不良事件记录表》
2.《可疑的非预期严重不良反应信息汇总表》
3.《伦理审查申请及受理表(临床试验版)(V2.0)》
药物临床试验伦理委员会
2020年07月09日
相关附件:
· 关于SAE SUSAR报告范围及要求的补充规定
 皖公网安备 34019102000817号
皖公网安备 34019102000817号